AgNO3 + FeCl2 → Ag + AgCl + Fe(NO3)3 là phản ứng . Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng AgNO3dư + FeCl2 → Ag + AgCl + Fe(NO3)3
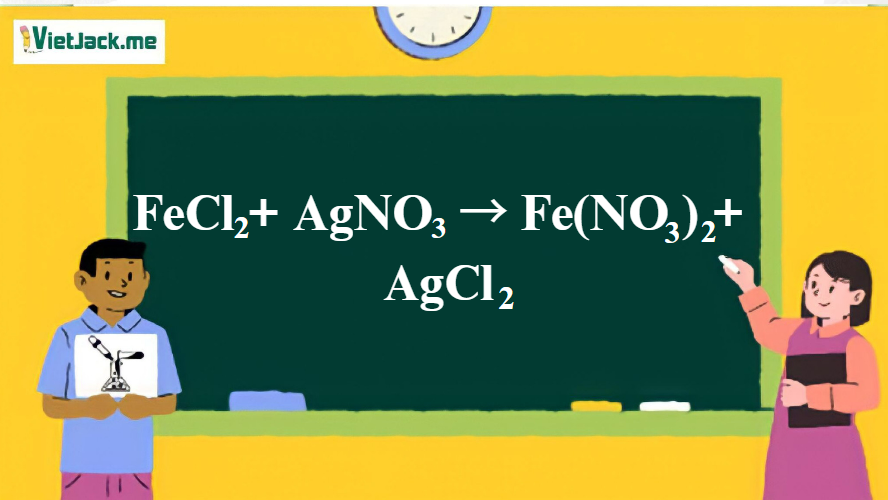
1. Phương trình phản ứng giữa FeCl2 và AgNO3 dư
3AgNO3 + FeCl2 -> Ag + 2AgCl + Fe(NO3)3
2. Điều kiện phản ứng xảy ra
Không có
3. Cách tiến hành phản ứng FeCl2+ AgNO3
cho AgNO3 tác dụng với dung dịch muối FeCl2
4. Hiện tượng sau phản ứng FeCl2 tác dụng với AgNO3
Xuất hiện kết tủa trắng bạc clorua (AgCl) và Ag.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của FeCl2
- Mang đầy đủ tính chất hóa học của muối.
- Có tính khử Fe2+ → Fe3+ + 1e
5.2 Bản chất của AgNO3
AgNO3 là chất dễ hoà tan trong nước và phân li mạnh. Ag+ sẽ kết hợp với ion NO3- tạo thành kết tủa màu trắng AgCl. (Chú ý: Phản ứng nhận biết muối amoni clorua).
6. Tính chất vật lý và tính chất hóa học của AgNO3
6.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212oC.
- Nhận biết: Sử dụng muối NaCl, thu được kết tủa trắng
AgNO3 + NaCl →AgCl↓+ NaNO3
6.2. Tính chất hóa học
- Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
6.3. Điều chế
Bạc nitrat điều chế bằng cách hòa tan kim loại bạc trong dung dịch axit nitric.
3Ag + 4 HNO3(loãng) → 3AgNO3 + 2H2O + NO
3Ag + 6 HNO3(đặc, nóng) → 3AgNO3 + 3 H2O + 3NO2
6.4. Ứng dụng
AgNO3 được sử dụng để tạo ra chất kết dính dẫn điện, máy lọc khí mới, quần áo cân bằng áp suất mạ bạc hay gang tay để làm việc trực tiếp. Nó cũng là vật liệu nhạy sáng cho phim, phim x-quang và phim ảnh. Được sử dụng để mạ bạc các linh kiện điện tử và thủ công mỹ nghệ khác…
7. Một số thông tin về muối sắt (II) clorua
Sắt(II) clorua là tên gọi để chỉ một hợp chất được tạo bởi sắt và 2 nguyên tử clo. Thường thu được ở dạng chất rắn khan.
Công thức phân tử: FeCl2
7.1. Tính chất vật lý sắt (II) clorua
Nó là một chất rắn thuận từ có nhiệt độ nóng chảy cao, và thường thu được dưới dạng chất rắn màu trắng. Tinh thể dạng khan có màu trắng hoặc xám; dạng ngậm nước FeCl2.4H2O có màu xanh nhạt. Trong không khí, dễ bị chảy rữa và bị oxi hoá thành sắt (III).
Nhận biết: Sử dụng dung dịch AgNO3, thấy xuất hiện kết tủa trắng.
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl↓
7.2. Tính chất hóa học sắt (II) clorua
Mang đầy đủ tính chất hóa học của muối.
Có tính khử Fe2+ → Fe3+ + 1e
- Tính chất hóa học của muối
Tác dụng với dung dịch kiềm:
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
Tác dụng với muối
FeCl2 + 2AgNO3→ Fe(NO3)2+ 2AgCl
- Tính khử
Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh:
2FeCl2 + Cl2 → 2FeCl3
3FeCl2 + 10HNO3→ 3Fe(NO3)3 + NO + 2H2O + 6HCl
7.3. Điều chế Sắt (II) clorua
Cho kim loại Fe tác dụng với axit HCl:
Fe + 2HCl → FeCl2 + H2
Cho sắt (II) oxit tác dụng với HCl
FeO + 2HCl → FeCl2 + H2O
8. Câu hỏi vận dụng
Câu 1. Cho 0,1 mol FeCl2 phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
A. 28,7
B. 39,5
C. 10,8
D. 17,9
Lời giải: Đáp án A
Phương pháp giải
Fe2+ + Ag+ → Fe3+ + Ag↓
Cl- + Ag+ → AgCl↓
=> mkết tủa = mAg + mAgCl
Câu 2: Chọn phương trình điều chế FeCl2 đúng?
A. Fe + Cl2 → FeCl2
B. Fe + 2NaCl → FeCl2 + 2Na
C. Fe + CuCl2 → FeCl2 + Cu
D. FeSO4 + 2KCl → FeCl2 + K2SO4
Câu 3. Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là:
- A. Fe(NO3)3.
- B. HNO3.
- C. Fe(NO3)2.
- D. Cu(NO3)2.
Đáp án: A. Fe(NO3)3.
Câu 4. Trong các phương trình sau, phương trình phản ứng nào có xuất hiện kết tủa trắng?
- A. Cho FeCl3 tác dụng với dung dịch AgNO3
- B. Cho FeCl3 tác dụng với dung dịch NaOH
- C. Cho FeCl3 tác dụng với H2S
- D. Cho FeCl3 tác dụng với NH3
Đáp án: A. Cho FeCl3 tác dụng với dung dịch AgNO3.
